Общие понятия действия антибиотиков и вопросы их применения.
Введение.
В окружающей среде находится огромное количество микроорганизмов, с которыми мы сталкиваемся каждый день. Также микроорганизмы есть и на поверхности кожи, и внутри каждого человека. Очевидно, в случае получения травмы в такой насыщенной биотой среде, рана будет загрязнена (контаминирована) различными микроорганизмами. Любые раны, кроме хирургических разрезов, проведённых в операционной в стерильных условиях, являются загрязнёнными и требуют применения антибиотиков как местных, так и общего действия для предотвращения дальнейшего развития инфекции и снижения риска осложнений.
Раны, сопровождающие боевые травмы, подвергаются отложенной хирургической обработке из-за увеличенного времени эвакуации. Поэтому аспект применения антибактериальных препаратов критически важен для медика на поле боя.
Важно помнить, что антибиотики НЕ РАБОТАЮТ против вирусов, простейших и грибов, вылечить инфекции, вызываемые этими патогенами невозможно с помощью антибактериальных препаратов.
Какие бактерии преобладают в окружающей среде?
Некоторые штаммы бактерий более распространены, чем другие, их можно обнаружить как в загрязнённых ранах, так и в окружающей среде, водоемах и почве.
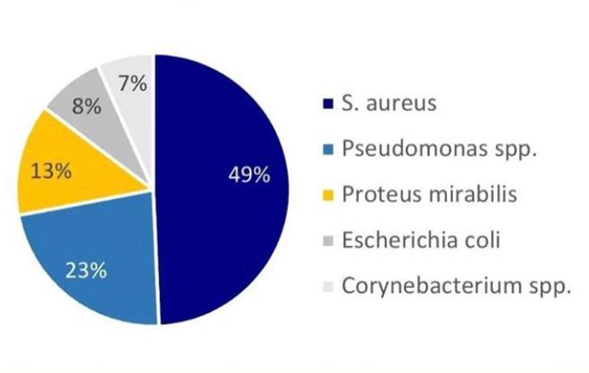
Наиболее часто встречающиеся при загрязнении ран штаммы это S. aureus и Pseudomonas spp.
Физиология бактерий и основные цели антибиотических препаратов.
Физиология бактерий достаточно сложна, но хотелось бы выделить основные процессы, на которые будут воздействовать различные классы антибиотиков.
1. Синтез фолатов, фолатный цикл.
Фолиевая кислота – достаточно важный кофермент для эукариотов и бактерий, который участвует в переносе групп для синтеза различных соединений (белков и нуклеиновых кислот). Таким образом, фолаты важны для процессов транскрипции и биосинтеза.
2.Клеточная стенка.
Защищает бактериальную клетку от окружающей среды. Состоит из муреина, пептидогликанов. Структура клеточной стенки лежит в основе разделения бактерий на грамположительные и грамотрицательные.
3.Клеточная мембрана.
Состоит из фосфолипидов, присуща всем живым организмам. Окружает цитоплазму и все находящиеся в ней органоиды, активно участвует в межклеточном транспорте, выполняет сенсорную и другие функции.
4.Синтез РНК.
Клеточная машинерия для синтеза и передачи генетической информации.
5.Рибосомы (полисомы).
Необходимые органеллы для синтеза белков.
Мишени для антибиотиков.
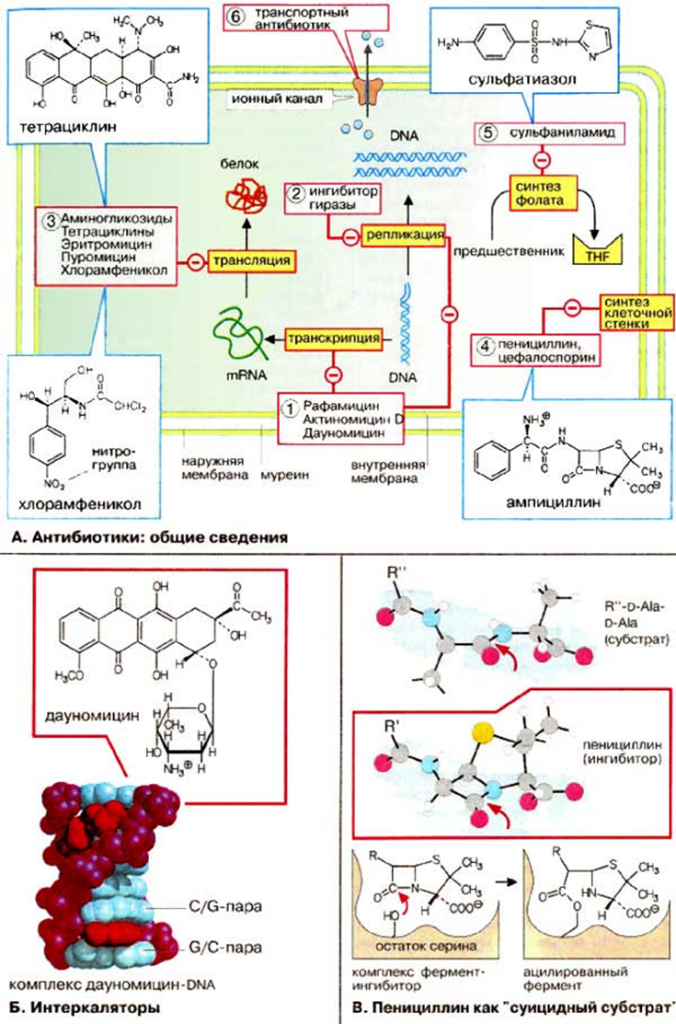
● Ингибиторы фолатов (Сульфаметаксазол, Триметоприм) и ингибиторы цитоплазматической мембраны (Даптомицин, Полимиксины). Транспортные антибиотики действуют подобно ионным каналам. Их встраивание в цитоплазматическую мембрану, что ведет к потере ионов или блокирует транспорт других веществ, что вызывает гибель бактериальных клеток.
● Другая мишень — аппарат синтеза клеточной стенки. У бактерии есть жесткая клеточная стенка (состоит из полисахаридов, которые связанны пептидами). Клетки млекопитающих такой стенки не имеют. Группа антибиотиков – ингибиторов синтеза клеточных стенок – не дает бактериям синтезировать эту структуру. Примеры: Ванкомицин, Пенициллин, Цефалоспорины, Карбапенем, Монобактамы, β-лактамные ингибиторы. Для них характерно наличие в структуре реакционноспособного β-лактамного кольца. Наиболее часто эти антибиотики используются для подавления грамотрицательных микроорганизмов, у которых они ингибируют синтез клеточных стенок.
● Третья мишень ― ДНК машинерия, фермент ДНК-гираза. В бактериальной клетке ДНК должна быть компактна, что обеспечивает фермент ДНК-топоизомераза II (ДНК-гираза). Также он способствует расхождению цепей двухцепочной ДНК в процессе репликации и транскрипции. На ДНК-гиразу действует природный антибиотик – налидиксовая кислота и ее синтетические аналоги – фторхинолоны. Синтетические ингибиторы ДНК-топоизомеразы II воздействуют на репликацию и тем самым подавляют репродукцию бактерий.
РНК-полимераза (считыватель генов) — тоже является мишенью некоторых антибиотиков, РНК ингибиторы: интеркаляторы (Рифампин, Метронидазол, Фторхинолоны, Актиномицин D), встраиваются в двойную спираль ДНК и препятствуют репликации и транскрипции. Поскольку ДНК имеет в основном одинаковую структуру во всех клетках, интеркаляторы токсичны и для эукариотических клеток, поэтому их применение в качестве цитостатиков в значительной степени ограниченно.
● Самая распространенная мишень для антибиотиков — аппарат биосинтеза бактериальных белков. В любых живых организмах белки синтезируются рибосомой — это специальная молекулярная машина, которая состоит из РНК и белков. Ингибиторы цикла рибосом: Аминогликозиды, Тетрациклины.
Механизмы воздействия антибиотиков.
Механизм воздействия антибиотиков на мишени следующий: в структуре мишени есть поверхности для взаимодействия определенной геометрической формы, которые распознаются антибиотиками, которые затем встраиваются в мишень и мешают работе клеточного механизма, например, не позволяют лиганду связаться с молекулой или могут приводить к сбоям в клеточной машинерии.
От того останавливает антибиотик работу молекул или приводит к нарушениям в механизмах клеточной регуляции, будет зависеть эффект – бактериостатический или бактерицидный. Антибиотики бактериостатического типа действия ингибируют рост бактерий, если убрать антибиотик, то бактерии начнут расти дальше. Антибиотики бактерицидного типа действия убивают клетку, если прекратить воздействие антибиотика, она не продолжит рост.
Тактика применения антибиотиков при боевой травме.
Примечание: рядом с названиями препаратов курсивом указана группа, к которой относится тот или иной препарат.
На этапах оказания первой помощи:- Антибиотики рекомендованы при всех типах боевых травм. Принять необходимо как можно раньше от момента получения травмы с учетом тактической обстановки.
– Если пострадавший в состоянии, принимается Моксифлоксацин (фторхинолоны) п/о 400мг (из носимого боевого набора таблеток – CWMP), затем по 400мг п/о один раз в день.
– Если пострадавший в состоянии шока, нарушен ментальный статус (не может глотать) или есть повреждение абдоминальной области, Эртапенем (β-лактамный антибиотик) 1г в/в, в/к, в/м один раз в день.
– При отсутствии Эртапенема применяется Цефтриаксон* (цефалоспорин) 1г (разведенный в лидокаине) в/в, в/к, в/м один раз в день (при тяжелой инфекции возможно увеличение дозировки).
Метаанализ исследований показал достаточную эффективность Цефтриаксона по сравнению с другими препаратами. Например, эффективность цефтриаксона составила 78% против 50% у стандартных антибиотиков, применяемых в клинической практике (nafcillin, oxacillin). При сравнении Цефтриаксона и Цефазолина для лечения метициллин-чувствительного золотистого стафилококка (MSSA) эффективность составила 86.2% и 90.2% соответственно. Есть научные доказательства, что Цефтриаксон не менее эффективен, чем другие антибиотики.
Также ряд исследований говорит о безопасности этого препарата по сравнению с другими антибиотиками, но, тем не менее, у него имеются противопоказания, и различные режимы дозирования, которые необходимо соблюдать для достижения оптимального результата лечения.
*Однако, ряд Российских хирургов замечают возрастающую резистентность к Цифтриаксону – учитывайте это.
На этапах дальнейшей помощи пострадавшему (PFC):
Если в ране развиваются признаки инфекции или наблюдаются системное заболевание, необходима идентификация патогена и обеспечение соответствующего лечения. Инфицированные раны необходимо лечить как местно, так и применяя системные антибиотики.
Системные антибиотики:
Продолжать курс 7–10 дней; Моксифлоксацин п/о 400мг один раз в день, Левофлоксацин (фторхинолоны) п/о 750мг один раз в день или Эртапенем 1г в/в один раз в день или любой альтернативный антибиотик широкого спектра действия. При длительном лечении рекомендуется менять антибиотики во избежание резистентности.
Другие из доступных антибиотиков:
●Амоксиклав (Амоксициллин + клавулановая кислота 875мг + 125мг)
(полусинтетический пенициллин + ингибитор β-лактамаз). Комбинация этих антибактериальных препаратов достаточно эффективна в отношении большого спектра микроорганизмов, включая S. аureus. Так как препарат относится к пенициллиновой группе, у бактерий развилась достаточно высокая резистентность, поэтому необходимо использовать комбинацию препаратов.
Примечание: с осторожностью в случае гиперчувствительности/аллергии на пенициллины.
Требуется регулярное применение (2–3 раза в сутки).
●Ципрофлоксацин (фторхинолоны) выпускается в формах для внутривенного введения (400мг за 1 час капельно 2 раза в сутки в течении 1–2 недель) или перорального применения (500мг 2 раза в сутки в течении 1—2 недель). Комбинируется с метронидазолом (500мг) для обеспечения более высокого фармакологического эффекта.
●Доксициклин (тетрациклин) (100 мг) показан в том числе для профилактики болезни Лайма после укуса клеща.
●Азитромицин (азалид) – антибактериальный препарат широкого спектра действия. Курс включает всего 3 таблетки, что упрощает применение и экономит место в медицинской укладке. Имеются устойчивые штаммы.
После курса антибиотиков для восстановления микробиома и иммунитета необходимо пропить курс эубиотиков.
Антибиотики для наружного применения:
●Стрептоцид (сульфаниламид) один из первых представителей сульфаниламидов, применяется наружно в составе комплексной терапии при лечении гнойных ран и инфицированных ожогов.
●Неомицин (глюкокортикостероид + аминогликозид + противогрибковое средство) аминогликозидный антибиотик. Применяется при инфекционно-воспалительных заболеваниях кожи, а также инфицированных ожогах и обморожениях. Не действует на анаэробных бактерий, устойчивость к препарату развивается медленно и в небольшой степени.
●Бацитрацин (полипептидный антибиотик) для профилактики инфекционно-воспалительных заболеваний при незначительных ранах, ожогах.
Резистентность к антибиотикам.
Бактерии могут развить механизмы противодействия определенным антибиотикам, если подвергаются регулярному и незначительному воздействию.
Генетически к развитию механизмов устойчивости приводит мутация генов, которые кодируют мишень антибиотика. В том месте, где антибиотик связывался, возникает измененная структура, и антибиотик связаться уже не может, таким образом мутации в активном центре молекулярной машины будут снижать эффективность антибиотиков.
Есть еще один механизм устойчивости — это синтез ферментов-насосов, которые или активно выкачивают антибиотик из бактериальной клетки, или разрезают его, или присоединяют к нему что-то ненужное, или модифицируют мишень антибиотика, встраивая туда другую химическую группу, чтобы место оказалось занятым и антибиотик связаться уже не мог.
Устойчивость может возникать как часть «бактериального иммунитета», когда в бактерии развиваются и активно используются механизмы экспрессии генов, отвечающие за детоксикацию: связывание опасного вещества, метаболизм и удаление метаболитов из клетки.
Разберем подробнее механизмы развития резистентности к антибиотикам у микроорганизмов:
1. Отсутствие мишени для антибиотика вследствие уменьшения проницаемости клеточной мембраны для антибиотиков;
2. Модификация мишени;
3. Активное выведение;
4. Ферментативная инактивация;
1) Часто резистентность обусловлена отсутствием мишени для антибиотика вследствие уменьшения проницаемости клеточной мембраны для антибиотиков. Устойчивость к антибиотикам иногда связана с нарушением проницаемости мембраны чаще при лечении инфекций, вызванных Serratia и P. aeruginosa. В результате мутаций возможна полная или частичная утрата поринов при изменении структуры липополисахаридов. β-лактамные препараты нарушают структуру цитоплазматической мембраны бактерий, тем самым облегчая транспорт аминогликозидов.
2) Модификация мишени действия — достаточно значимый механизм устойчивости бактерий. Пример: мишенями действия β-лактамов являются ферменты, участвующие в синтезе клеточной стенки бактерий. В результате модификации этих ферментов уменьшается сродство к β-лактамным антибиотикам. Особенно этот механизм устойчивости развит у стафилококков и пневмококков.
3) В резистентности бактерий к макролидам и линкосамидам определенное значение имеет и такой механизм, как активное выведение антибиотиков, кодируемое mef-генами, распространенными среди многих грамположительных бактерий. (У стафилококков и энтерококков активное выведение макролидов осуществляют транспортные системы другого типа, кодируемые генами msr).
4) Ферментативная инактивация – это один из основных видов формировании резистентности. Ферменты бактерий, которые инактивируют антибиотик, обладают следующими свойствами:
– Субстратный профиль (способность к гидролизу определенных антибиотиков);
– Локализация кодирующих генов (плазмидная или хромосомная);
– Чувствительность к применяющимся в медицинской практике ингибиторам: клавулановой кислоте, сульбактаму и тазобактаму.
Например, синтез β-лактамаз, которые связываются с β-лактамными антибиотиками. Связывание β-лактамазы с β-лактамным антибиотиком катализирует гидролиз аминной связи лактамного кольца, что и приводит к инактивации антибиотика.
У некоторых микроорганизмов существуют и другие системы для ферментативного инактивирования антибиотиков. Например, для борьбы с аминогликазидами присоединяется к ним другая химическая группа (ацетилирование, аденилирование, фосфорилирование). Для борьбы с этим механизмом образования резистентности используют неконкурентные ингибиторы пенициллиназ (например, клавулановая кислота). Но эти препараты используют в комплексе лечения с антибиотиками.
Антибиотик-резистентные бактерии могут распространяться бесконтрольно и последующее применение антибиотиков для лечения инфекции будет НЕЭФФЕКТИВНО. Поэтому абсолютно необходимо принимать антибиотики таким образом, чтобы не создавать резистентные штаммы. НЕ принимайте антибиотики самостоятельно до консультации со специалистом!
Почти половина антибиотиков, используемых человеком, не нужны или не уместны. Например, треть людей считает, что антибиотики эффективны для лечения обычной простуды, простуда является наиболее распространенной причиной назначения антибиотиков, даже с учетом того, что антибиотики не работают против вирусов. Однократный прием антибиотиков даже при соблюдении режима лечения приводит к увеличению риска резистентности микроорганизмов к этому антибиотику в организме человека на период от месяца и, возможно, до года.
Итоги:
– В боевых условиях почти все раны загрязнены практически со 100% вероятностью и требуют применения антибиотиков.
– Каждый комбатант должен иметь в носимой аптечке антибиотический препарат в составе набора боевых таблеток.
– Первое применение антибиотика рекомендовано CoТССС как можно раньше от получения ранения; препарат выбора Моксифлоксацин п/о и/или Эртапенем в/в, в/к, в/м. Альтернативные препараты указаны выше.
– Не пользуйтесь антибиотиками без показаний. Употребление низких доз антибиотика и прерывание курса ведет к развитию резистентности.
Источники:
Nature reviews| Microbiology. 12, 35–48 (2014).
Wilson, D. Ribosome-targeting antibiotics and mechanisms of bacterial resistance.
Koolman, Röhm. Color Atlas of Biochemistry. 2012 English edition.
Peter Russell. iGenetics: A Molecular Approach. 2013 English edition.
Nelson, Cox. Lehninger Principles of Biochemistry. International Edition 2021.
The pathogenesis and diagnosis of sepsis post burn injury. Feb 2021. Pengju Zhang, Bingwen Zou, Yih-Cherng Liou, Canhua Huang.
The impact of initial antibiotic treatment failure: Real-world insights in patients with complicated, health care-associated intra-abdominal infection. Jan 2019. Pascale Peeters, Kellie Ryan, Sudeep Karve, Jesús Rodríguez-Baño.
TCCC Guidelines, JTS/CoTCCC. 12/1/2022
McNulty C. A., Boyle P., Nichols T., Clappison P., Davey P. The public’s attitudes to and compliance with antibiotics. 2007.
editors, Ronald Eccles, Olaf Weber,. Common cold. — Online-Ausg.. — Basel: Birkhäuser (англ.)рус., 2009. — С. 234. — ISBN 978-3-7643-9894-1.
2022 Centers for Disease Control and Prevention, National Center for Emerging and Zoonotic Infectious Diseases (NCEZID), Division of Healthcare Quality Promotion (DHQP), About Antimicrobial Resistance
2017 год. МЕХАНИЗМЫ ФОРМИРОВАНИЯ РЕЗИСТЕНТНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ Е.С.Привалова, О.С.Ситкина, С.Б Марасанов, Т. А. Лукомник
Outcomes of Patients Discharged on Parenteral Ceftriaxone Compared with Oxacillin or Cefazolin in Methicillin-susceptible Staphylococcal aureus (MSSA) Bloodstream Infections. October 2019. Lee Erik Connor, Yasir Hamad, Ige George.
Methicillin-Sensitive Staphylococcus aureus (MSSA) Septicemia-Outcomes of Ceftriaxone Compared with Cefazolin and Oxacillin Outpatient Therapy from a Large National Sample. December 2021. Yasir Hamad, Katelin B, Nickel Margaret, A Olsen, Ige George.
Effectiveness and Safety of Ceftriaxone Compared to Standard of Care for Treatment of Bloodstream Infections Due to Methicillin-Susceptible Staphylococcus aureus: A Systematic Review and Meta-Analysis by Yazed Saleh Alsowaida, Gregorio Benitez, Khalid Bin Saleh, Thamer A. Almangour, Fadi Shehadeh and Eleftherios Mylonakis.
Efficacy of Ceftriaxone 1 g daily Versus 2 g daily for The Treatment of Community-Acquired Pneumonia: A Systematic Review with Meta-Analysis. João Paulo Telles,Juliette Cieslinski,Juliano Gasparetto & Felipe Francisco Tuon. 10 Jun 2019.
Efficacy of ertapenem, gentamicin, fosfomycin, and ceftriaxone for the treatment of anogenital gonorrhoea (NABOGO): a randomised, non-inferiority trial. Prof Henry J C de Vries, Myrthe de Laat, Vita W Jongen, Titia Heijman, Carolien M Wind, Anders Boyd, et al. January 19, 2022.
